Перевод статьи зарубежной статьи: о препаратах для лечения меланомы интерлейкин-2, Ервой и Зелбораф.
И в конце, действие препарата Зелбораф на опухоль меланомы. По мне дык совершенно уникальное фото.
Прислала девушка, которую зовут Оля. И за статью, и за фото ОГРОМНОЕ СПАСИБО! Ну и конечно же искренне желаю победы над болезнью ее близкому человеку!
Сначала статья:
Рассмотрим иммунотерапию как первую линию лечения.
Применение иммунотерапии становится все более сложным, поскольку мы учимся контролировать многие сигналы которые активируют и деактивируют Т клетки. Сейчас мы имеем две утвержденных иммунотерапии для метастатической меланомы – большие дозы интерлейкин — 2 (пролейкин) и Ервой (ипилимумаб) – и, по крайней мере, две терапии в стадии исследования – терапия восприимчивых T-клеток и новые антитела к PD-1 – которые особенно перспективны. Dr. Mario Sznol
Без сомнений, если говорить об одном агенте или сравнивать два препарата, ипилимумаб проигрывает Зелборафу (вемурафенибу), целевому ингибитору BRAF, с точки реакции, прогрессирования болезни и средней выживаемости. Но нашей целью является лучший результат в целом, в данной группе, и в связи с этим, секвенирование агентов вступает в игру, и появляются преимущества первичной иммунотерапии.
Первым из нескольких факторов, которые необходимо учитывать при выборе начальной терапии является то, что иммунотерапия дает продолжительную и стойкую ремиссию; например, около 5% пациентов получавших большие дозы интерлейкин-2 имеют ремиссию 2 года, в некоторых случаях 10 лет, часто без поддерживающей терапии. В противоположность этому, практически все пациенты, получающие целевые агенты требуют некоторые виды дополнительной терапии в стадии прогресса.
Второе, фактическая продолжительность иммунотерапии довольно ограничена, и пациенты восприимчивые к ней могут и не требовать вторичной терапии. Но при целевой терапии, насколько мы можем видеть, пациенты вынуждены придерживаться этой терапии постоянно.
Третий фактор это быстрая реакция. Реакция на иммунотерапию медленная, в некоторых случаях она занимает не менее 12 недель, в то время как реакция при целевой (таргетной) терапии видна через несколько дней. Поэтому трудно давать пациенту иммунотерапию, если приходится ждать прогресса, в то время как целевая терапия действует очень быстро, но вместе с тем целевую терапию можно успеть применить в том случае если иммунотерапия не даст результата.
Также следует отметить, что при целевой (таргетной) терапии есть вероятность молниеносного рецидива. Наш небольшой опыт показывает, что некоторая подгруппа пациентов имеет очень быстрый прогресс когда терапия прекращает действовать и агенты уже не действуют, но в этой точке терапии уже нет возможности проводить иммунотерапию.
Нужно отметить, что пациенты с большими опухолями и очень быстрым прогрессированием болезни при начальном метастазировании не лучшие кандидаты для первоначального проведения иммунотерапии.
Поэтому вы действительно должны смотреть на общее состояние пациента и брать во внимание такие маркеры как низкое количество базовых лейкоцитов(не одобряется при иммунотерапии) и существующие аутоиммунные заболевания (исключает иммунотерапию и целевую терапию).
Четвертое, есть предположение, что проведение иммунотерапии первично, а целевой терапии вторично может быть синергетическим. Предположительно, это чисто теоретически. Но идея в том, что ипилимумаб, например, остается в организме 3 месяца, поэтому если пациент показывает улучшение на этой стадии и в тоже время получает целевую терапию, то по существу вы и проводите комбинированную терапию.
Также, противоопухолевый иммунитет может играть важную роль в эффективности целевой терапии. Очень интересные доклинические испытания показали что в некоторых случаях целевая терапия требует реакции иммунитета , таким образом стимуляция или улучшение иммунитета в начале может дать лучший эффект при целевой терапии в дальнейшем. Клинически были представлены доказательства, что Вемурафениб индуцирует Т-клеточный инфильтрат в опухоли.
В заключение, есть основания советовать первичную иммунотерапию при лечении меланомы. В настоящее время, мы иногда должны сделать сложный выбор первичной терапии опираясь на данные о пациенте, существующей информации, и наши клинические показатели. Но в будущем лечение будет проводиться путем комбинирования, чтобы оптимизировать результаты. Эти испытания планируются. Будут рассмотрены все виды возможных комбинаций, чтобы улучшить результат терапии.
Dr. Sznol является профессором онкологии и со-директором программы в Yale Cancer Center, New Haven, Conn. Также он является консультантом Bristol-Myers Squibb (производитель ipilimumab) и Genesis Biopharma (разработчик дополнительной клеточной терапии).
Целевая терапия BRAF-имеет наилучшие показатели выживаемости.
Половина меланом имеют мутацию BRAF, что дает возможность целевой терапии и в настоящее время является перспективной . Вемурафениб (Зелбораф) дает быстрый, иногда мгновенный результат у многих пациентов. В BRIM-2, фаза II испытания среди пациентов, кому не помогла предыдущая терапия, почти у всех была регрессия при приеме вемурафениба и более чем 50% достигли ремиссии (критерии оценки опухоли) клинических реакций (N. Engl. J. Med., in press). В BRIM-3, фаза III испытания среди пациентов не получавших лечения, вемурафениб дает значительные улучшения по обоим показателям-выживаемость без и выживаемость с дакарбазином в соотношении 0.26 и 0.37, соответственно. Dr. Jeffrey A. Sosman
Одно заблуждение касательно терапии вемурафенибом, что все пациенты имеют рецидив через 6-7 месяцев и умирают. Выживаемость без прогрессирования заболевания имеет в среднем 6,8 месяцев, но мы видим впечатляющие увеличение выживаемости, до 15.9-месяцев в среднем при BRIM-2, возможно это самый долгий период среди всех проведенных испытаний. На 63% уменьшение риска смертности при BRIM-3 с vemurafenib практичекси у всей подгруппы пациентов, но самым впечатляющим было у пациентов с высоким уровнем лактатдегидрогеназы (LDH) или M1c болезнью. Мы вряд ли получим более высокий уровень выживаемости при этих испытаниях из-за ранее благоприятного результата и возможности совмещения лечения.
Другое заблуждение о терапии vemurafenib что все пациенты имеют очень агрессивный рецидив, и не имеют возможности повторного лечения. На самом деле, многие пациенты имеют локализированный рецидив, проходят резекцию, и могут продолжать прием Зелбораф (вемурафениб). Мой опыт показывает что пациенты, у которых агрессивный рецидив, это те у которых агрессивная форма болезни изначально, и те, которым никакая другая терапия не подходит. Они получат значительное улучшение, но не так долго, как хотелось бы.
При всех ограничениях сравнений между испытаниями, vemurafenib по сравнению с ипилимумабом дает более высокий процент выживаемости в течении 1 года (54%-58% против 46%) и в течении 2 лет (33% против. 24%). И есть огромное улучшение в контролировании прогресса заболевания (86% против. 44%).
Без сомнения, некоторые пациенты имеют длительную ремиссию при иммунотерапии, но основная проблема в том, что мы не можем выбрать первичная или вторичная терапия пациентов даст такой результат.
Вемурафениб возможно единственная эффективная терапия для симптоматических пациентов с высоким уровнем LDH , которым требуется быстрое улучшение. Откровенно говоря, я не видел больше пациентов с такими результатами как при лечении вемурафениб (Зелбораф).
В конечном итоге, возможно есть несколько научных предположений, что прием Вемурафениба после Ипилимумаба (Ервоя) лучше, но нет никаких результатов показывающих что вы не можете достигнуть длительной ремиссии при приеме Ипилимумаба после прекращения действия BRAF ингибитора. Для изучения последовательности этий терапий требуется больше времени. При BRIM-2, только 5% пациентов первоначально принимают ипилимумаб. И хотя анализ был сделан среди 24% принимавших ипилимумаб после прекращения Вемупафениба, это анализ постфактум, и целью является просто выяснить любые вмешательства, которые помогут продлить жизнь.
В завершение, в эпоху целевых агентов, важно чтобы все меланомы разделились по генотипам. С мой точки зрения те пациенты у которых симптоматичное массивное поражение или повышенный уровень LDH получали Зелбораф. Пациенты с вялотекущей болезнью, бессимптомной M1a или M1b болезнью, должны получать другое лечение; я не могу с уверенностью утверждать что все они должны получать Вемурафениб. Но если вы пытаетесь добиться ремиссии у пациента на более длительный срок, тогда Вемурафениб наиболее предпочтителен. В конечном счете, нам требуются испытания которые смогут оценить последовательную и комбинаторную терапию.
Dr. Sosman профессор медицины и директор программы по меланоме в Vanderbilt-Ingram Cancer Center, Nashville, Tenn. Он также является консультантом, и получает поддержку от GlaxoSmithKline (производитель целевых терапевтических препаратов против меланомы) и Roche (производитель вемурафениба).
Ну и напоследок:
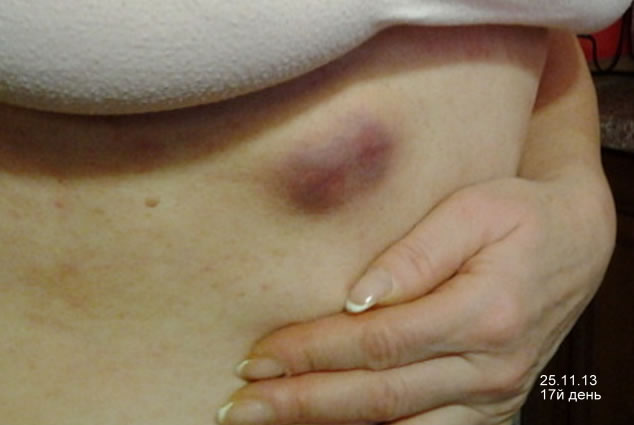
Действие препарата Зелбораф на опухоль
5й — 13й день приема препарата.
И еще:
17й день приема Зелборафа.











Это очень интересно, хорошо что наткнулся на ваш сайт. Спасибо вам.